1 Gasgesetze
1.1 Zusammensetzung der Luft
1.1.1 Einatemluft
|
Anteil |
Gas |
|
21 % |
Sauerstoff ( O2 ) |
|
78 % |
Stickstoff ( N2 ) |
|
1 % |
Restgase |
Anmerkung: Um genau zu sein kommt noch der Wasserdampfanteil in der Luft dazu. Er ist z.B. bei 18 Grad Celsius und 60 % rel. Luftfeuchte ca. 1.2 Volumenprozent. Da die Summe aller Anteile immer 100% ist verringern sich die Anteile aller anderen Gase dementsprechend.
1.1.2 Ausatemluft
|
Anteil |
Gas |
|
17 % |
Sauerstoff ( O2 ) |
|
4 % |
Kohlendioxid ( CO2 ) |
|
78 % |
Stickstoff ( N2 ) |
|
1 % |
Restgase |
1.2 Druck
1.2.1 Gasdruck
Der Druck wird definiert als Kraft durch Fläche, also die Kraft (z.B. Gewichtskraft des Wassers) die auf eine bestimmte Fläche (z.B. den Taucher) ausgeübt wird. Die Einheit des Drucks ist bar bzw. in anderen Ländern oft auch psi.
Umrechnung:
|
BAR |
|
Sonstige |
BAR |
|
PSI |
|
1 bar |
= |
14.5 psi |
30 bar |
= |
435 psi |
|
1 psi |
= |
0.0689 bar |
50 bar |
= |
725 psi |
|
1 bar |
= |
100.000 Pa (Pascal) |
100 bar |
= |
1450 psi |
|
1 bar |
= |
10 N/cm2 |
200 bar |
= |
2900 psi |
1.2.2 Wasserdruck
Der Druck beträgt an der Wasseroberfläche ca. 1 bar.
Unter Wasser nimmt der Druck alle 10 Meter um 1 bar zu.
Änderung des Wasserdrucks:
|
Tiefe |
|
Druck |
|
0 m |
= |
1 bar |
|
10 m |
= |
2 bar |
|
20 m |
= |
3 bar |
|
30 m |
= |
4 bar |
|
40 m |
= |
5 bar |
|
... m |
= |
... bar |
Wie man sieht verdoppelt sich der Druck die ersten 10 m beim Abtauchen, bzw. halbiert sich die letzten 10 m beim Auftauchen, also um den Faktor 2.
Taucht man von 20 auf 10 m auf, so verringert sich der Druck um 1/3,
taucht man von 30 auf 20 m auf, so verringert sich der Druck um 1/4, usw.
Deshalb treten besonders bei den letzten 10-15 m beim Auftauchen besonders große Druckunterschiede auf, die deshalb auch bei zu schnellem Auftauchen, bzw. bei Luftanhalten zu Verletzungen führen können!
Siehe auch das Gesetz von Boyle und Mariotte.
Faustformel:
![]()
1.2.3 Gas-Partialdruck - (Gesetz von Dalton)
Mit zunehmender Tiefe nimmt der Druck zu. Aber nicht nur auf uns, sondern auch auf das eingeatmete und im Körper befindliche Gasgemisch. Der Druck hat aber nicht nur Einfluss auf das Gesamt-Gasgemisch, sondern auch auf alle darin enthaltenen Gase. An der Wasseroberfläche (1 bar Druck) sind die Teildrücke (Partialdrücke) im Gasgemisch analog zu den Volumenprozent des jeweiligen Gases, also:
|
Anteil |
|
Druck |
|
21 % |
= |
0.21 bar |
|
78 % |
= |
0.78 bar |
|
1 % |
= |
0.01 bar |
|
Summe |
1.00 bar |
Mit zunehmendem Wasserdruck, nehmen auch die Partialdrücke zu, und zwar um den
Faktor des steigenden Druckes:
Faustformel:
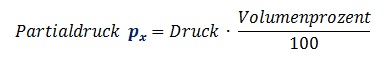
Beispiel:
Tauchtiefe: 30 m => Druck: 4 bar
|
Gas |
Anteil |
Druck |
→ |
Rechnung |
= |
Teildruck |
|
O2 |
21 % |
4.0 bar |
→ |
4 * (21/100) |
= |
0.84 bar |
|
N2 |
78 % |
4.0 bar |
→ |
4 * (78/100) |
= |
3.12 bar |
|
Rest |
1 % |
4.0 bar |
→ |
4 * (1/100) |
= |
0.04 bar |
Anmerkung:
Entsprechend des Teildruckes wird auch ein Gas im Blut gelöst (Gesetz von Henry).
Es wird ersichtlich, dass bei größeren Tiefen somit auch immens mehr Stickstoff aufgenommen wird. Waren in einer bestimmten Menge Blut es an der Wasseroberfläche z.B. 21 Moleküle O2 und 78 Moleküle N2, (also nur 57 N2 Moleküle mehr) gelöst, so wären dies in 30 m Tiefe 84 Moleküle O2 und 312 Moleküle N2, (also nur 228 N2 Moleküle mehr !!!).
Um die so ggf. "gespeicherten" O2 Moleküle gefahrlos wieder abzubauen sind eine langsame Aufstiegsgeschwindigkeit (weniger als 10 m pro Minute) und Dekompressions- bzw. Sicherheits-Stopps notwendig. Technische Taucher verwenden dazu außerdem während eines Tauchganges unterschiedliche Gasgemische um damit eine übermäßige Sättigung mit O2 und N2 zu vermeiden.
Anm: Ab 71 m hat man bei Druckluft einen O2-Partialdruck von 1.7 bar, ab dem Sauerstoff toxisch wirkt (z.B. epileptische Anfälle).
1.3 Druck und Volumen: Das Gesetz von Boyle und Mariotte
Das Gesetz von Boyle und Mariotte drückt das Wechselwirken zwischen Druck (p) und Volumen (V)
eines Gases aus. Mit zunehmendem Druck wird das Gas zusammengedruckt und somit kleiner (also p*V=konstant).
Dadurch ergibt sich das Gesetz von Boyle und Mariotte:
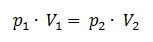
Damit kann die Änderung des Volumens bei einer Änderung des Druckes (und umgekehrt) berechnet
werden.
Beispiel:
Tiefe: 15m, das Volumen der Lunge ist 6 Liter.
Es erfolgt ein Aufstieg auf 5 Meter Wassertiefe.
Auf welches Volumen dehnt sich die Luft in der Lunge aus ?
Rechnung:
p1=2.5 bar (15 m Wassertiefe) und V1=6 l
p2=1.5 bar ( 5 m Wassertiefe) . V2=gesucht
p1 * V1 = p2 * V2 => beide Seiten der Gleichung durch p2 teilen
( p1 * V1 ) / p2 = V2 => Zahlen einsetzen
V2 = ( 2.5 bar * 6 l ) / 1.5 bar
V2 = 10 l
Antwort:
Das Volumen hat sich auf 10 Liter ausgedehnt. Da die Lunge kaum dehnbar ist, hätte sie einen Schaden genommen (Lungenriss) falls der Taucher beim Aufstieg nicht ausgeatmet hätte!
Deshalb muss beim Aufstieg die Atemluft stets ausgeatmet werden.
Die Luft darf nie angehalten werden!
1.4 Druck und Temperatur
1.4.1 Das Gesetz von Gay-Lussac
Mit zunehmendem Druck erwärmt sich ein Gas, mit abnehmendem Druck kühlt ein Gas ab.
( p/T = konstant)
Gesetz von Gay-Lussac:
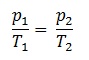
Dabei wird mit T = Kelvin gerechnet.
Um Grad Celsius und Kelvin umzurechnen gilt folgendes:
T [Kelvin] = Grad [o Celsius] + 273
Grad [o Celsius] = T [Kelvin] – 273
Anmerkung:
Der "normale" Taucher braucht das Gesetz v.a. für 2 Sachen:
- Beim Füllen der Flasche kann die Flasche ganz schön heiß werden.
- Beim starkem Luftverbrauch in kalten Gewässern kann sich die Luft dadurch so stark abkühlen, dass der Atemregler vereist.
1.4.2 Der Joule-Thomson-Effekt
Der Joule-Thomson-Effekt beschreibt den Effekt, dass Gase bei sehr hohen Drücken (und das ist bei den Tauchflaschen mit 200 bar bereits leicht, bei 300 bar sogar sehr der Fall) sich nicht mehr wie "normale" (ideale" Gase) verhalten. Bei niedrigen Temperaturen treten Wechselwirkungen zwischen den Gas-Molekülen auf, die ein "aneinanderkleben" der Gasmoleküle und Verflüssigungseffekte bewirken (Das Gesetzt von Gay-Lussac geht von idealen Gasen aus und berücksichtigt diese Effekte nicht).
(makabere) Aufgabe für den Fortgeschrittenen Profi (Dank an Dirk "Kaleu" für die Anregung):
Aufgabe:
Ein Atom-U-Boot taucht in 2000 m Tiefe. Alle Schotten sind offen. Plötzlich brechen die Torpedo-Schotten im Bug und das Boot läuft schlagartig voll Wasser. Woran stirbt der Maschinist im Heck des U-Bootes?
Rechnung:
p1 / T1 = p2 / T2 daraus folgt: T2 = (p2 * T1) / p1
p1 = 1 bar (vorher), T1 = 20 OC (vorher) = 293 K, p2 = 201 bar (nachher)
T2 = (201 bar * 293 K) / 1 bar
T2 = 58893 K = 58620 OC
Lösung:
Er verbrennt bei 50000 - 60000 OC zu Asche ... (bevor er nass wird).
(darum sollte man auch als Nicht-Taucher "seinen" Gay-Lussac kennen ...)
(PS: für Skeptiker: auch wenn es vorher im U-Boot kälter oder wärmer gewesen wäre, oder das Atom-U-Boot nur auf 1000 Meter Tiefe gewesen wäre, dann hätte der Druck immer noch eine Temperatur von ca. 30000 OC erzeugt, was ja auch reicht ...
(PSS: für Nörgler: 500 m: ca. 15000 OC, 250 m: ca. 7500 OC, 100 m: ca. 3000 OC [reicht immer noch] ))
1.5 Gase in Flüssigkeiten
1.5.1 Die Rolle der Gase im Körper
Stickstoff N2 ist nicht (kaum) an Abläufen im Körper beteiligt. Es heißt deshalb auch "Inertgas". Es wird durch den vorherrschenden Partialdruck im Blut gelöst d.h. es wird bei hohem Außendruck in die Flüssigkeit (Blut) "gedrückt", bis ein Gleichgewichtszustand erreicht ist. Je länger der höhere Außendruck Zeit zum Einwirken (Herstellen des Gleichgewichtszustandes) hat, desto mehr Stickstoff kann gelöst werden (daher die längeren Dekozeiten bei langen, tiefen Tauchgängen).
Sinkt der Außendruck, so entweicht der Stickstoff wieder aus dem Blut. Bei starkem Druckabfall kann es zur Blasenbildung des Stickstoffes (aneinanderlagern der N2-Moleküle) kommen - ein Effekt wie man ihn von Sprudelflaschen kennt. Blasen im Blut können (wichtige) Gefäße und Kapillargefäße verstopfen und somit das betroffene Gewebe (durch Mangelversorgung) schädigen oder zum Absterben bringen.
Sauerstoff O2 ist essentiell wichtig um die Körperfunktionen aufrecht zu erhalten. Er wird im Blut zu 97% an das Hämoglobin der Erythrozyten (rote Blutkörperchen) gebunden und so zu den Organen im Körper transportiert. Nur ein geringer Anteil von 3% ist im Blut gelöst. An seinem Verbrauchsort wird der Sauerstoff gegen Kohlendioxid CO2 ausgetauscht. Das Kohlendioxyd diffundiert zu 70% in die Erythrozyten (roten Blutkörperchen) und in die Eiweiße des Blutes. Nur ein geringer Teil ist im Blut gelöst. Das Kohlendioxyd wird so in die Lunge transportiert und über die Alveolen (Lungenbläschen) abgeatmet. Somit ist der Vorrat an Sauerstoff und Kohlendioxid nicht im Blut gelöst, sondern fast vollständig (chemisch) gebunden.
Anmerkung:
(1) Gase wie Kohlenmonoxid CO sind deshalb so gefährlich, da sie sich "stärker" an die roten Blutkörperchen binden (Sauerstoff wird abgegeben und Kohlenmonoxid) wird gebunden. Außerdem dauert es sehr lange (auch nachdem kein Kohlenmonoxid mehr eingeatmet wird), bis das Kohlenmonoxid wieder von den roten Blutkörperchen "losgelassen" wird. Das Körper kann deshalb nicht mehr mit ausreichend Sauerstoff versorgt werden und es treten Bewusstlosigkeit und/oder Tod ein.
(2) Edelgase (darunter fällt zum größten Teil auch das 1 % Restgase in der Atemluft) verhalten sich weitgehend wie Stickstoff und sind an keinen Körperfunktionen beteiligt).
1.5.2 Das Gesetz von Henry
Gase lösen sich in Flüssigkeiten, was allerdings Zeit benötigt. Ist die Flüssigkeit gesättigt, so stehen die in der Flüssigkeit gelösten Gase in direktem Verhältnis zum Verhältnis der Teildrücke des Gases an seiner Oberfläche. Oder einfacher: Gase lösen sich im Blut im gleichen Verhältnis wie sie auch im Atemgemisch vorkommen.
Beispiel:
Tauchtiefe: 30 m → Druck: 4 bar
|
Gas |
Anteil |
Druck |
Rechnung |
Teildruck des Gases |
||
|
O2 |
21 % |
4.0 bar |
=> |
4 * (21/100) |
= |
0.84 bar |
|
N2 |
78 % |
4.0 bar |
=> |
4 * (78/100) |
= |
3.12 bar |
|
Rest |
1 % |
4.0 bar |
= > |
4 * (1/100) |
= |
0.04 bar |
Anmerkung:
(1) Entsprechend des Teildruckes wird auch ein Gas im Blut gelöst (Gesetz von Henry).
Es wird ersichtlich, dass bei größeren Tiefen somit auch immens mehr Stickstoff aufgenommen wird. Waren es an der Wasseroberfläche in einer bestimmten Menge Blut z.B. 21 Moleküle O2 und 78 Moleküle N2, (also nur 57 N2 Moleküle mehr) gelöst, so wären dies in 30 m Tiefe 84 Moleküle O2 und 312 Moleküle N2, (also nur 228 N2 Moleküle mehr!)
(2) Der Effekt wird dadurch verstärkt, dass Sauerstoff im Blut nicht gelöst vorliegt, sondern an die roten Blutkörperchen gebunden ist. Bei 1 bar sind die meisten roten Blutkörperchen "besetzt" (unser Körper ist effektiv und hat nichts zu verschenken). Auch bei steigendem Partialdruck kann deshalb kaum mehr Sauerstoff gebunden werden, dafür werden aber große Mengen Stickstoff gebunden.
(3) Sauerstoff wirkt ab einem Partialdruck von ca. 1.7 bar (1.7 bar / 0.21 = 8,1 bar entspricht ca. 71 Meter Tiefe) schädlich. Es verringert die Isolationswirkung unserer Nerven (im Gehirn) wodurch Ausfallerscheinungen, Krämpfe und Bewusstlosigkeit eintreten können (ein [Stimmritzen-] krampf endet unter Wasser meist tödlich). Langfristig (Berufstaucher) greift es bei diesen hohen Partialdrücken auch die Schutzschicht der Lungenbläschen an, so dass diese (dauerhaft) verkleben können.
Will man tiefer als 71 m tauchen, so muss man den Sauerstoffdruck senken. Wie schon erwähnt sind bei einem Druck von 1 bar bereits fast alle roten Blutkörperchen belegt. Es reicht an Sauerstoff also im Prinzip die Menge Moleküle, die bei Normaldruck vorhanden sind. Technische Taucher tauchen viele hundert Meter tief und haben z.B. nur wenige Prozent Sauerstoff im Atemgemisch (natürlich auch keinen Stickstoff, sondern schneller ab-atembare Gase).
Folgende Faktorenbeeinflussen die Lösung (Diffusion) eines Gases in Flüssigkeit:
Druck (Tauchtiefe), Zeit (Tauchzeit), Oberfläche (je größer die Oberfläche, desto größer die Sättigung – spielt bei den Geweben eine Rolle), Gasart, Temperatur (je kälter, desto mehr Gas ist gelöst), Gewebeart (schnelle/langsame Gewebe – Herz, Knochen, Haut, Fettgewebe, …)
